2022-04-07 14:18 | 来源:证券时报 | | [科创板] 字号变大| 字号变小
由公司披露的续标情况、中标价格以及标期可以初步判断,集采到期后,短期培美曲塞二钠产品的营收不会出现大幅度下降。...

4月6日,在第一批集采中爆火的抗肿瘤药企汇宇制药(688553)披露了上市以来首份年报。年报显示,2021年,公司实现营业收入182,373.31万元,同比上涨33.69%。归属上市公司股东净利润44,585.86万元,同比增长29.87%。归属于上市公司股东的扣除非经常性损益的净利润40,993.71万元,同比增长26.22%。
主力产品集中度稳步下降新品类走出第二增长曲线
据2021年报,期内培美曲塞二钠已在广东联盟(河南、贵州、广西、海南、湖南、山西、甘肃、青海、新疆、广东)继续中标,中标价格 599元/支(100mg),标期2年;在江苏继续中标,中标价格525元/支,标期2年,视情况可延长一年;其余地区新招标方案出台落实之前,均按原中选企业延续执行。
由公司披露的续标情况、中标价格以及标期可以初步判断,集采到期后,短期培美曲塞二钠产品的营收不会出现大幅度下降。此外,公开数据显示,近三年培美曲塞二钠占公司主营业务收入的比重分别为92.77%、91.02%、79.49%,昔日拳头产品已逐渐摘掉汇宇制药“仿制药唯一大单品”标签,公司早已默默启动了多条仿制药“第二增长曲线”。
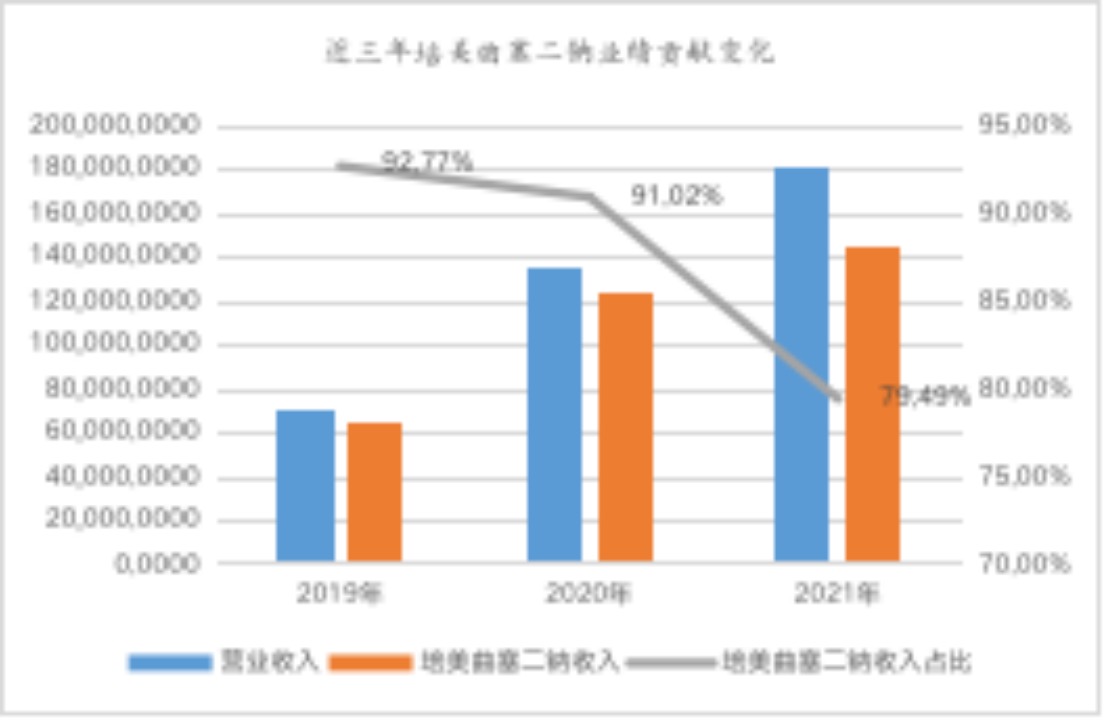
数据来源:wind
截至年报披露日,公司有注射用培美曲塞二钠、多西他赛注射液、注射用阿扎胞苷、紫杉醇注射液、奥沙利铂注射液、注射用盐酸苯达莫司汀、伊立替康注射液、盐酸帕洛诺司琼注射液、注射用硼替佐米、左乙拉西坦注射用浓溶液等10个药品获批上市,多个品种为首家或前三家视同通过注射剂一致性评价。其中注射用培美曲塞二钠、多西他赛注射液、注射用阿扎胞苷、紫杉醇注射液、奥沙利铂注射液、注射用盐酸苯达莫司汀、伊立替康注射液分别进入国家集采。报告期内,公司产品注射用阿扎胞苷销售大幅增长,第五批集采产品中选销售增长迅速;报告期培美曲塞二钠实现销售收入144,690.54万元,较上年同期增长17.09%;多西他赛注射液销售收入15,063.78万元,较上年同期增长64.68%;注射用阿扎胞苷实现销售收入10,540.31万元,较上年同期增长487.69%。
汇宇制药在此前披露的机构调研记录中表示,虽然培美曲塞在已续接标地区价格有所下降,但第三批国家集采中选药品阿扎胞苷会持续增长,第五批集采中标的4个品种已开始供货,2022年将开始放量贡献收入,第七批集采公司伊立替康已被纳入集采品种,第八批集采预计也会有产品纳入。同时目前公司注册待批准的有12个品种,其中普乐沙福单价非常高,丙戊酸钠、氟维司群等市场容量很大。另外,预计公司2022将递交注册约20个品种,不同阶段的仿制药、复杂注射剂陆续都会递交注册并获批,将会有持续不断的品种获批上市,为公司贡献收入。
由此来看,类似汇宇制药这样在集采政策下能够持续长期收益的仿制药企业,离不开其较强科研能力,以及丰富的产品线等核心竞争力因素,以此为基础,汇宇制药的大多数产品才能率先通过一致性评价,并持续在带量采购模式下抢占市场。
仿制药持续快速发展推动“以仿养创”模式愈发稳健
汇宇制药的战略发展路径是“以仿养创—仿创结合—以创为主”的三步走规划,故免不了面临所有走“以仿养创”模式的药企,共同要面对的质疑点:用仿制药能否支撑创新药研发的巨大投入?以仿养创模式的“续航”能力究竟如何?
首先,从在售产品来看,截至报告披露日,在国内,公司有注射用培美曲塞二钠、多西他赛注射液、注射用阿扎胞苷、紫杉醇注射液、奥沙利铂注射液、注射用盐酸苯达莫司汀、伊立替康注射液、盐酸帕洛诺司琼注射液、硼替佐米、左乙拉西坦注射用浓溶液等10个药品获批上市,多个品种为首家或前三家视同通过注射剂一致性评价,营销网络覆盖全国各省、市、自治区超过2000家等级医院;在海外,公司已有12个品种获批上市,超过200个批件(含自主持有及授权合作方持有),覆盖51个国家和地区,同时已在约100个国家建立了销售渠道,累计在境外超过40个国家、超过1000家医疗机构上市销售。从近三年稳定增长的营业收入及净利润情况看,现有仿制药产品市场空间及回报均相对稳定。
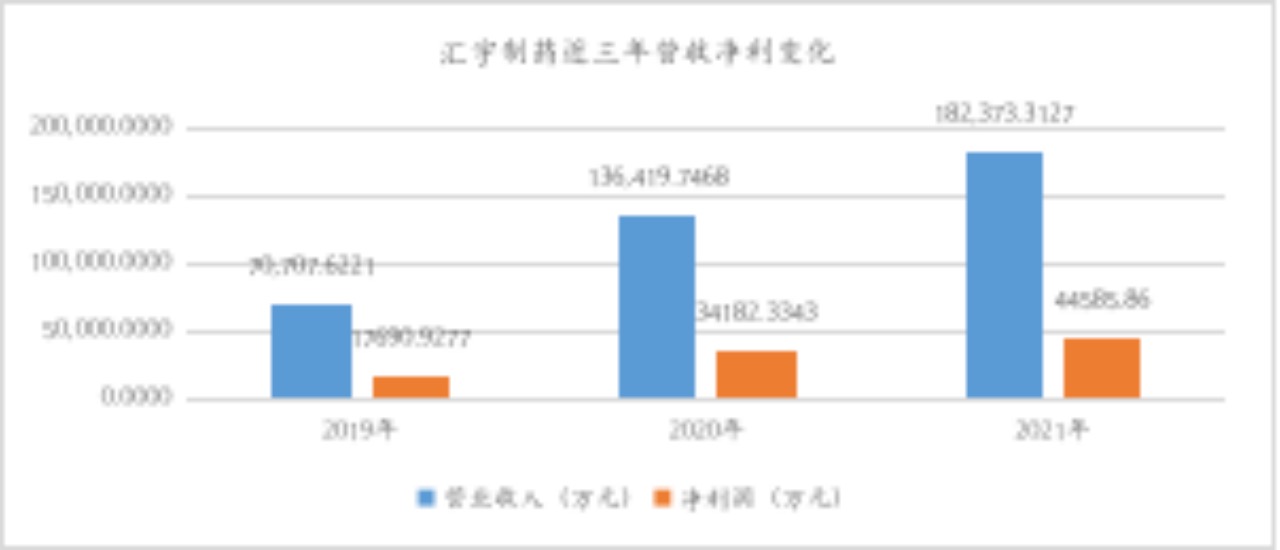
数据来源:wind
其次,从新产品及研发管线情况看,报告期内,汇宇制药中标第五批全国药品集中采购,中标品种包括奥沙利铂注射液、多西他赛注射液、紫杉醇注射液以及注射用苯达莫司汀,并于2021年9月开始陆续执标,其中奥沙利铂注射液、紫杉醇注射液以及注射用苯达莫司汀均为公司新增国内上市品种,将为公司贡献新的业绩增长点。
另外,汇宇制药在年报中还披露了国际市场前景极大的复杂注射剂相关产品进展。年报显示,公司的复杂注射剂等重磅品种将会从今年开始陆续申报国内外注册,包括戈舍瑞林、兰瑞肽、环磷酰胺、紫杉醇白蛋白、多柔比星脂质体、铁剂等。这些复杂注射剂均具有市场规模大、技术壁垒高、有实力的竞争者少等特点。举个例子,公开数据显示,2020年国内多柔比星脂质体销售额已超过41亿,戈舍瑞林植入体在中国院内市场规模为30.50亿元,前景不可限量。
汇宇制药在年报中也表示,在中短期公司仍着力仿制药研发,一方面品种数量多、管线丰富,另一方面复杂注射剂等重磅品种将会从今年开始陆续申报国内外注册。综合在售产品,待售新产品,以及储备在研项目的情况,汇宇制药在仿制药领域持续收益、为创新药研发不断造血的能力还是有明确数据支撑的。
创新药重磅产品将报临床研发管线兑现确定性强
随着创新药概念板块的理性回调,以及国家政策引导下对创新药的真创新能力、国际竞争力的要求,资本市场对于“以仿养创”阶段的企业何时能够踏上创新药轨道的关注,就变得更加明确且急迫。
汇宇制药称,在创新药领域重点布局的是全球范围内同类产品尚未进入临床研究阶段的first-in-class和me-better品种,从靶点方向上看符合可持续发展的创新药企基础条件。年报数据显示,2021年公司研发费用24,821.22万元,同比增长179.60%,其中创新药研发投入7,558.22万元,同比增长720.51%。
在研发团队上,汇宇制药共有研发人员642名,同比增长超过50%,其中创新药团队139名,包括硕士和博士89名,且牵头人毕业于剑桥、哈佛、北京大学等全球知名院校,此外,汇宇制药还从海外产业界挖了不少大牛,比如在美国SNTA负责一类FIC创新药团队管理和药物研发的高级总监陈寿军,以及礼来的首席科学家和资深研究顾问韦涛。
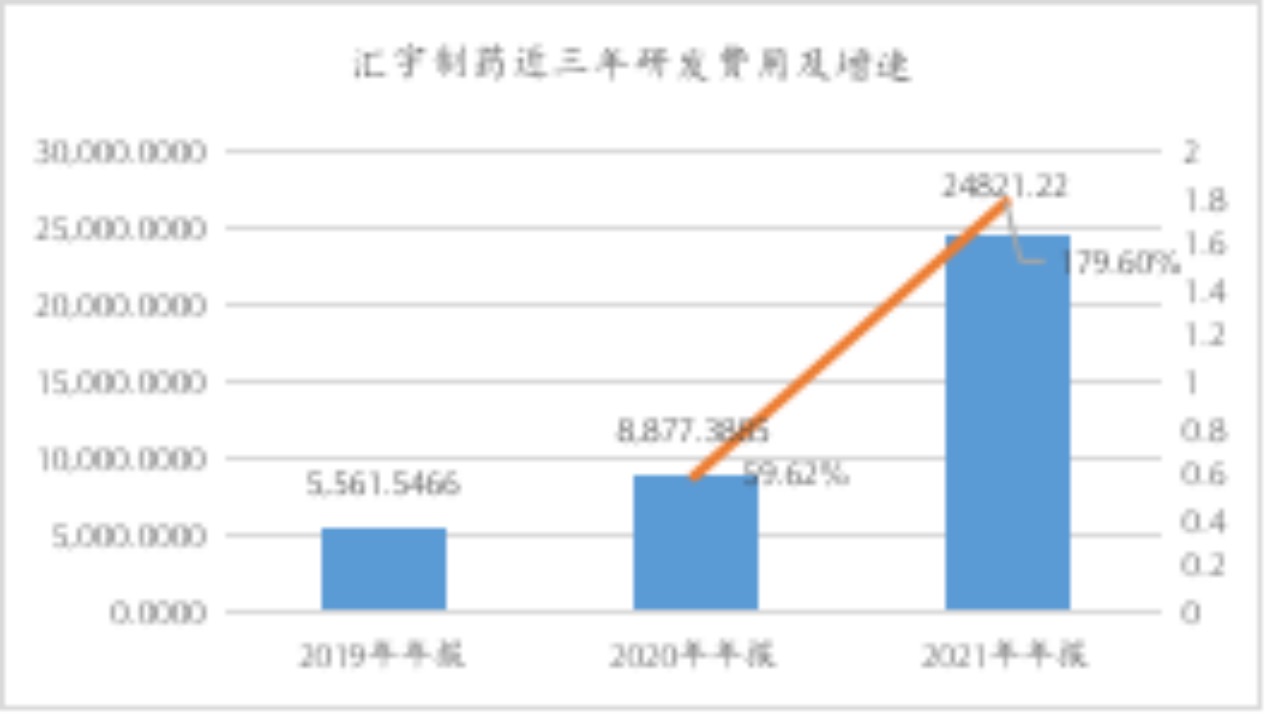
数据来源:wind
对于创新药的最新研发进展,汇宇制药在年报中披露,2021年,公司全面加速生物和化学创新药研发,持续完善团队建设和技术平台建设,搭建并完善了创新药研发的各个平台,各项体系和管理日趋成熟,为创新药全力冲刺夯实了基础。同时10个一类创新药项目都取得了良好进展,基本都找到了较好的潜在候选药物。2022年,公司预计将有约5个一类创新药推进至PCC阶段,力争1-2个产品申报临床公司。同时,创新药海外市场的准备工作已经同步开展。目前,公司已在美国成立子公司,并设立了“美国和创新药事业部”,后续公司将大力推进创新药海外授权相关工作。这无疑是汇宇制药迈向“仿创结合”模式的一个重大突破。
已启动美国FDA认证工作国际市场布局全球开花
在国际市场基础布局方面,期内公司在英国已经获得11个药品的上市许可,海外自主和授权合作方持有批件总数超过200个,覆盖51个国家;在质量体系标准方面,公司多次通过了中国、英国的GMP 认证,并通过芬兰GMP认证,目前已启动美国FDA认证相关工作;在国际注册法规把控方面,公司建设和培养了一支理论和实操经验丰富的优秀国际注册团队。
该团队通过全面掌握药事法规,协助研发部门快速研发出符合国际注册法规的药品,实现了生产、技术、质量和销售部门合规运行,结合公司强大的研发能力、符合欧美GMP标准的生产和质量体系,各自的优势互相配合形成了相互促进的协同效应。以上逐步积累起来的国际化优势,无疑将成为汇宇制药未来迈向全球的有力武器。
《电鳗快报》
热门
相关新闻